Neurowissenschaften & Musik: Ein Blick in das menschliche Gehirn und die Magie der Musik
 Margarete M. Ertl, Deutschland
Margarete M. Ertl, Deutschland
Dirigentin, Gesangspädagogin
Diesem Artikel liegt ein Vortrag zugrunde, der Teil des WSCM 12 in Auckland, Neuseeland, hätte sein sollen. Da das Symposium abgesagt werden musste, bietet das ICB Ihnen hier die Gelegenheit, durch eine geschriebene Fassung ein wenig in das Thema hineinzuschnuppern.
Werfen Sie einen Blick in die faszinierende Welt der Neurowissenschaften und erhalten Sie einen Einblick in die Symphonie der Nervenzellen. Die ersten Wahrnehmungen von »musikalischen Elementen« stimulieren bereits vor der Geburt das menschliche Gehirn. Bei jeder musikalischen Wahrnehmung, jeder Probe und jedem Konzert erweitern Dirigenten, Komponisten oder Sänger die Komplexität ihres persönlichen neuronalen Netzwerkes.
Beim Singen verarbeitet das menschliche Gehirn mehr als nur sprachliche und musikalische Strukturen. Es steuert autonome Körperfunktionen, die Beweglichkeit des Stimmapparates, der Augen und Gliedmaßen oder die Körperhaltung. Aufgrund sensorischer und audio-visueller Reize korrigiert es Muskelbewegungen im Allgemeinen bis hin zu deren Feinjustierung. Gleichzeitig speichert es Informationen, denkt voraus, berechnet, findet Lösungen, fokussiert sich streng auf eine Sache und verarbeitet optische Reize aus Partitur und Dirigat. Es kontrolliert permanent Atmung und Stimme in Bezug auf Tonhöhe, Tonfarbe, Tempo, Präsenz, Rhythmus und die Klangfarbe von Vokalen und Konsonanten in verschiedenen Sprachen. Es lernt, erinnert sich an Kommentare und die Anforderungen an den musikalischen Ausdruck. Sänger interagieren mit anderen Musikern nicht nur musikalisch, sondern auch emotional und sozial. Sie synchronisieren ihre Stimmen mit den Mit-Musikern und berücksichtigen akustische Anforderungen. Das Ohr ist permanent in Bereitschaft – konzentriert auf die eigene Stimme, auf alle Geräusche aus der Umgebung und analysiert diese in Bezug auf ihre akustischen Prioritäten. Darüber hinaus steuern im Hintergrund chemische Prozesse persönliche Empfindlichkeiten und Emotionen. Um diese Fähigkeiten ständig zu verbessern, ist ein hochkomplexes neuronales Netzwerk erforderlich.
Dieser Artikel fasst den aktuellen Stand der Forschungsergebnisse auf dem Gebiet des Singens und der Neurowissenschaften zusammen. Eine schillernde Reise in die Magie der Musik: Sie erhalten zunächst einen Blick in das menschliche Gehirn und dessen Nervensystem. Danach werden bildgebende Verfahren vorgestellt, mit denen die Aktivitäten in den verschiedenen Strukturen des menschlichen Gehirns, während der komplexen Stimmverarbeitung sichtbar gemacht werden. Abschließend führt das Thema in die Anatomie des Gehirns und öffnet ein Fenster in ein spannendes Fachgebiet der jüngsten Forschung. Es werden neuronale und interaktive Prozesse in verschiedenen Gehirnregionen vorgestellt, die nach den Erkenntnissen renommierter Forscher durch das Singen aktiviert werden.
Die neurowissenschaftliche Forschung entschlüsselt mit Hilfe modernster bildgebender Diagnosetechnik Schritt für Schritt die Verarbeitung neuronaler Prozesse. Damit werden faszinierende Details über die Aktivität des Gehirns beim Singen, der Vorstellung und dem Hören von Musik enthüllt – eine Symphonie der Neuronen. Lange lag der Schwerpunkt der neuronalen Forschung auf der Musikverarbeitung und bei den Instrumentalisten. In letzter Zeit rückt auch das Singen und die hochkomplexe neuronale Verarbeitung dieser Funktion mehr und mehr in den Fokus der Forschung.
Ungefähr 80 Milliarden Neuronen kommunizieren ununterbrochen miteinander. Elektrische Impulse und chemische Prozesse interagieren mit grauer Substanz (Neuronen und Gliazellen) und weißer Substanz (myelinisierte Axone). Die Strukturdichte der Gehirnsubstanz nimmt mit elektrischer oder chemischer Erregungsleitung zu, oder ab, wenn Verbindungen inaktiv sind. Die elektrischen Impulse können mit der Patch-Clamp-Technik hörbar gemacht werden. Auf diese Weise können Wissenschaftler beides: Daten sammeln und der neuronalen Symphonie in Echtzeit zuhören. Unser Gehirn verarbeitet nicht nur Informationen, sondern ist in gewisser Weise selbst “Musik” oder “singt” unsere Gedanken ins Dasein.
Neuronen regulieren alles: vom autonomen Nervensystem bis hin zur Verarbeitung und Auswertung von Wissen, und steuern eine große Anzahl von Netzwerken zwischen den Gehirnbereichen (Luo et al., 2019). Die Kommunikation von Neuronen an den Synapsen wird als synaptische Plastizität bezeichnet[1]. Neuronen, Axone und Gliazellen kommunizieren mit anderen Neuronen am Ursprungsort oder im Zielbereich (neuronale Plastizität – Fig 1). Ein Neuron kann sich mit bis zu 10 000 anderen Neuronen zu einer Gesamtkapazität von bis zu 1000 Terabyte vernetzen (Bartol et al., 2015). Darüber hinaus sind Asterozyten und Microglia an Reparaturprozessen und Informationsübermittlung zwischen Neuronen beteiligt. Synaptische und neuronale Plastizität sind gut dokumentiert. Dagegen ist nicht abschließend geklärt, ob das erwachsene menschliche Gehirn in der Lage ist, neue Neuronen zu bilden (“Neurogenese” in subventricularer Zone, Striatum und Hippocampus).

Korbinian Brodmann war ein Pionier bei der Kartierung des menschlichen Gehirns. 1909 identifizierte er 52 verschiedene histologische Hirnareale (Brodmann-Bereiche – BA). Er konnte jedoch nur pathologische Gehirne untersuchen. Die heutigen modernen Bildgebungsverfahren ermöglichen einen Blick in das aktive, lebende Gehirn. Zwei prominente Teilnehmer an Bildgebungsstudien waren Herbert von Karajan und Rénee Fleming. Karajan nutzte bereits in den 1970er Jahren mehrere Gelegenheiten, um Daten erfassen zu lassen, während er dirigierte (Müller, 2005). Fleming war fasziniert, 2017 Teil einer fMRI-Studie sein zu können, die untersuchte, wie das Gehirnnetzwerk bei professioneller Gesangstechnik arbeitet.
Entsprechend dem Aufbau der Untersuchungen werden die gesammelten Daten der gewählten Bildgebungstechnik konvertiert, gerendert und zu atemberaubenden farbigen Bildern aufbereitet, die die “Regions Of Interest” (ROI) zeigen. Elektroenzephalographie (EEG) und Magnetoenzephalographie (MEG) sind die am häufigsten verwendeten, nicht-invasiven Bildgebungstechniken, um Regionen zu untersuchen, die beim Singen Aktivität in grauer Gehirnsubstanz zeigen. Das EEG erreicht nur Strukturen an der Oberfläche des Gehirns und hat eine geringe räumliche Auflösung. Jedoch werden hier Änderungen der elektrischen Aktivität in Echtzeit, beinahe im Millisekundenbereich aufgezeichnet. Das MEG, mit einer ähnlichen Auflösung wie das EEG, wird verwendet, um die Magnetfelder zu messen, die durch elektrische Gehirnströme erzeugt werden.
Konzentriert sich die Forschung auf das Volumen der grauen Substanz, oder den Verlauf und den Umfang der Nervenfasern der weißen Substanz, sind Bildgebungstechniken mit einer höheren räumlichen Auflösung erforderlich. Häufig werden dazu Magnetresonanztomographie (MRT – Fig 2a) und die funktionelle MRT (fMRT) verwendet. Sie stellen die anatomischen Strukturen des Gehirns auch in subkortikalen Bereichen bildlich dar. Das Verfahren erkennt die Veränderungen des Sauerstoffgehalts im Blut und den Blutfluss als Reaktion auf neuronale Aktivität. Das “Blood-Oxygen-Level Dependent” (BOLD) ist eine spezielle Methode der fMRT zur Messung der Stimmaktivität in den betreffenden Gehirnregionen, bei der die unterschiedlichen magnetischen Eigenschaften von sauerstoffarmem und sauerstoffreichem Hämoglobin verwendet werden.
Eine zunehmende Erregungfrequenz aktiviert Olygodendrozyten, eine Myelinscheide um das Axon (Nervenfaser) zu bilden. Damit ändert sich das Aktionspotential von einer kontinuierlichen Erregungsleitung entlang des Axons hin zu einer saltatorischen Übertragung von einem nicht myelinisierten Bereich (Ranvier-Schnürring) zum nächsten. Dies beschleunigt die Übertragung elektrischer Impulse um ein Vielfaches. Ein Oligodendrozyt kann beim Lernprozess oder auch beim Wiederherstellen unterbrochener Verbindungen bis zu 50 Neuronen myelinisieren. Oligodendrozyten können auch Axone demyelinisieren, um Informationen zu löschen und um Verbindungen zu trennen. Die Diffusions-Tensor-Bildgebung (DTI – Fig. 2b) erkennt diese Fasern bis ins kleinste Detail. Wie MRT und fMRT ist das DTI-Verfahren nichtinvasiv und nutzt die spezifische Eigenheit der Richtungsbewegung von Wassermolekülen entlang der Nervenbahnen, um die Verknüpfungen und Strukturen von Fasern der weißen Substanz zu bestimmen.
Weitere nichtinvasive Diagnosetechniken zur Erfassung ergänzender Daten bei den Untersuchungen der Stimmgebung sind die Magnetresonanzspektroskopie (Messung biochemischer Prozesse in einem starken Magnetfeld) oder hochauflösende 3D-Mikroskopbildgebungstechniken (Fig 2c). Sie ermöglichen ein präzises Scannen von Proben im Nanometer- und Subnanometerbereich. Die Single-Photon-Emissions-Computertomographie (SPECT) und die Positronen-Emissions-Tomographie (PET) verwenden kurzlebiges radioaktives Material. Trotz ihrer geringen Auflösung bilden beide Methoden funktionelle Prozesse effektiv ab, indem sie den Blutfluss messen. Bereiche mit hoher Radioaktivität sind mit einer hohen Gehirnaktivität in den subkortikalen Regionen verbunden.
Jedes Bildgebungsverfahren hat Vor- und Nachteile. Zusammengefasst verbessern die Ergebnisse der einzelnen Ansätze und der ROI das Verständnis der neuronalen Zusammenhänge beim Singen.
Das anatomische Hauptmerkmal des menschlichen Gehirns ist die gefaltete Struktur der Hemisphären, verbunden durch das Corpus Callosum. Die verschiedenen Bildgebungstechniken bestätigen eine Lateralisierung des Zentralnervensystems. Das heißt: Die Hemisphären haben bilateral angelegte Bereiche, die an der Verarbeitung unterschiedlicher Funktionen beteiligt sind. Einige werden linksdominant, andere rechtsdominant oder beidseitig gleichberechtigt gesteuert. Die linke Hemisphäre ist auf schnelle, die rechte Hemisphäre auf langsame Verarbeitung spezialisiert (Poeppel, 2003).
Gesang- und Sprachbereiche sind bekannte Beispiele für eine Lateralisierung. Sie wechseln zwischen linken und rechten Sprachverarbeitungsbereichen und teilen sich diese auch. Die Sprachmotorik und einige Aspekte der syntaktischen Verarbeitung sind hauptsächlich in Bereichen der linken vorderen Hemisphäre lokalisiert, einschließlich des Broca-Areals (BA44/45). Das Zentrum für das Sprachverständnis befindet sich vorranging in der linken hinteren temporal-parietal Region einschließlich des Wernicke-Areals (BA22). Das linke Planum temporale ist im menschlichen Gehirn bis zu zehnmal größer als sein rechter Gegenpart (ein sensibler Bereich für die Tonhöhenwahrnehmung im BA22). BA44/45 zeigen dagegen ein größeres Volumen in der rechten Hemisphäre. Der Sulcus centralis, der den primären motorischen Cortex (M1-Vokaltrakt) beherbergt, ist ebenfalls in der rechten Hemisphäre tiefer und größer. (Corballis, 2014; Toga et al., 2003; Albouy et al., 2020).
Unerwartetet war das Forschungsergebnis, dass ein größeres Volumen in der grauen Substanz oder in den Nervenfasersträngen keinen Vorteil “per se” im Vergleich zwischen Nichtmusikern und Musikern bedeutet. Die Hirnregionen werden durch intensives Üben effizienter genutzt und eine gesteigerte sensorische Rückmeldung verbessert die Feinabstimmung der Muskulatur, wie hier am Beispiel der Stimmverarbeitung illustriert. Dies kann in einigen Bereichen als stärkere physiologische Struktur gemessen werden, aber nicht zwangsläufig. Man nimmt an, dass ein Netz von höherer Synapsendichte pro Neuron und einer größere Gliazellendichte an dieser effektiveren Verarbeitung beteiligt ist (Gaser, Schlaug, 2003).
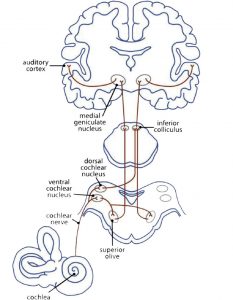
© Butler B., 2013
Musik wird sofort mit dem Gehörsinn verbunden. Die Myelinisierung der Axone im primären auditorischen Cortex beginnt bereits im Mutterleib im letzten Drittel der Schwangerschaft. Das neuronale Hör-Netzwerk (Fig 3a) hat bis zur Verarbeitung eines auditiven Reizes schon eine ereignisreiche Wegstrecke hinter sich. Die Schallwelle erreicht als mechanischer Impuls das Trommelfell. Die Flüssigkeit in der Cochlea leitet den Impuls an die äußeren und inneren Haarzellen des Corti-Organs, die Stereozilien, weiter. Diese ändern ihre Position und geben an ihre Haarzellen einen Impuls. Chemische Transmitter strömen in den synaptischen Spalt, um Ca2 + -Kanäle zu öffnen. Dies erzeugt einen elektrischen Impuls für die Hörbahn: von den Nuclei cochleares über den Nucleus olivaris superior, den Colliculi inferiores und dem Nucleus geniculatus medialis im Thalamus bis zum primären auditorischen Cortex, dem Hörzentrum (A1) im Gyrus temporalis superior (STG). Hier wird der Impuls weiter an diejenigen Netzwerke geleitet, die die Informationen des Klangs und die bewusste Wahrnehmung von Tönen auswertet (Cheung et al., 2017).
Der Heschl‘sche Gyrus (HG) entspricht dem Hörzentrum A1 (Fig 3b). Er ist eng mit der Klangwahrnehmung verknüpft und beeinflusst das musikalische Ergebnis auch mit seiner Morphologie, seiner Form, Größe und Asymmetrie. Ein größeres Volumen im rechten HG weist auf eine bevorzugte Klangerkennung und Klangverarbeitung über Obertöne hin, bei denen der Ton in seine verschiedenen Komponenten zerlegt wird. Die Bevorzugung der Grundtonhöhe zur Wahrnehmung des Klangs als Ganzes führt zu einem größeren Volumen im linken HG (Brenner, Schneider et al., 2017). Für Instrumentalisten ist dies gut dokumentiert. Weitere Untersuchungen sind erforderlich, um den Unterschied zwischen Obertonhörern und Grundtonhörern bei Sängern zu untersuchen, bzw. inwieweit ein größerer (rechter oder linker) HG den Klang eines Chores beeinflussen kann.
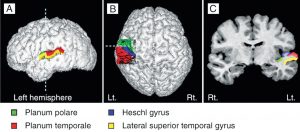
Die Gehirnstrukturen von Sängern und Instrumentalisten unterscheiden sich erheblich. Im Gegensatz zu Instrumentalisten ist das Instrument der Sänger, die Stimme, ein Teil ihres Körpers. Sie wächst und altert mit dem Körper und wird ständig über die Sprache und den Gesang beansprucht. Sänger verlassen sich nicht nur auf die akustische Wahrnehmung, sondern nutzen ebenso die sensomotorische Rückkoppelung während des Prozesses der Gesangserzeugung. Die während des lebenslangen Lernens erarbeitete Gesangskompetenz wird in einem größeren Volumen der grauen Substanz im auditorischen (z.B. HG), bzw. motorischen Bereich (z.B. SMA) oder im Cerebellum sichtbar. Außer diesen sind die Kommissurenfasern oder die Assoziationsfasern in der weißen Substanz von höherer Dichte und deren Volumen ist in der linken Hemisphäre größer als bei Instrumentalisten. (Loui, 2015; Schlaug et al., 2011).
Die Großhirnrinde wird in Frontal-, Temporal-, Parietal- und Okzipitallappen mit 27 Sulci und 16 Gyri, Cerebellum und Hirnstamm (Fig 4) unterteilt. Unter der Großhirnrinde befinden sich weitere innere Strukturen: das limbische System, Basalganglien und die weißen Nervenfasern. Kommissurenfasern (Corpus Callosum, Fornix) sorgen für den Informationstransfer und die Verbindung zwischen den Hemisphären. Assoziationsfasern (Fasciculus arcuatus/ Fasciculus longitudinalis/ Fasciculus uncinatus) verbinden Gehirnregionen tief in derselben Hemisphäre. Projektionsfasern sind die Verbindung zum Rückenmark. Diese Strukturen reagieren primär oder sekundär auf das Singen.
Die bewußte Steuerung des Bewegungsablaufs von Sprach- und Gesangerzeugung aktiviert ein hochkomplexes hierarchisch organisiertes Netzwerk. Dargestellt in Form einer Karte (Fig 5a) kristallisieren sich Hauptknotenpunkte heraus, die ihrerseits weitere Verzweigunspunkte mit unterschiedlicher Rangordnung unter- und miteinander verbinden. Das neuronale Netzwerk läßt also eine persönliche und absolut individuelle Gehirnkarte entstehen (Fig 5b). Sich ein umfassendes Bild von diesem komplexen Netzwerk zu machen, stellt eine Herausforderung dar, und es ist atemberaubend einen Bereich nach dem anderen zu analysieren (atlas.brainnetome.org/bnatlas.html).
Das zentrale Netzwerk beim Singen ist das hierarchisch organisierte Stimmkontroll-Netzwerk. Entscheidende Bereiche sind der vordere cinguläre Cortex (ACC – ein wichtiger Knotenpunkt in der Musikverarbeitung), der untere Parietal- und Okzipitallappen, ein Teil des limbischen Systems und das periaquäduktale Grau (PAG) im Mittelhirn des Hirnstamms (Fig 6). Sie geben die Informationen an die phonatorischen Motoneuronen weiter, die für die Bereitschaft oder Einleitung der Stimmerzeugung zuständig sind (Jürgens, 2009). Diese Regionen sind wiederum mit jenem Netzwerk verbunden, das allgemein für das Erlernen der Stimmerzeugung zuständig ist. Es besteht aus M1 im Frontallappen und Regionen, die die Feinjustierung der Stimmgebung aus dem motorischen Cortex regeln: Putamen und Globus Pallidus, Pontingrau (Pons) und Cerebellum. Die Information über eine Feinjustierung wird über den Thalamus wieder an M1 zurückgeleitet. Zusätzlich sind verschiedene neuronale Regionen der Hörbahn daran beteiligt (wie oben beschrieben). Beim Vergleich von Tonhöhen einzelner Noten oder in Melodien werden Bereiche innerhalb und außerhalb des Temporallappens im Hörzentrum und Frontallappenbereichen aktiviert. Die Klangfarbe der Stimme wird im Sulcus temporalis superior (STS) innerhalb des Temporallappens verarbeitet. Die Spracherkennung wird im vorderen STS (aSTS) verarbeitet. Das Klangspektrum der Stimme und der Vergleich von Ton zu Geräusch wird im mittleren vorderen STS und das Erkennen unbekannter Stimmen im hinterem STS (pSTS) verarbeitet. Sulcus intraparietalis (IPS) und rückwärtiger prämotorischer Cortex verarbeiten die sensorischen Reize als Impuls für die Muskelbewegungen. Die Rückmeldung dieses Reizes zum Bewegungs- und Gleichgewichtssinn (Atemwege/Kehlkopf) wiederum, wird im primären somatosensorischen Cortex (S1) des Parietallappens und der Insula verarbeitet. (Kleber, Zarate, 2014). ACC, pACC, pSTS, IPS, AIC und Cerebellum interagieren miteinander, um die motorischen Abläufe der komplexen Fähigkeit der Stimmerzeugung zu steuern.
Der anteriore, also vordere, Cortex insularis (AIC) und das Cerebellum sind wichtige Zentren der Sprachverarbeitung und sind eingehender zu betrachten. Der AIC erfasst Informationen aus den auditorischen, somatosensorischen, visuellen und motorischen Regionen. Seine entscheidende Rolle beim Singen zeigt sich im Kehlkopf (linker dorsaler AIC) und im Zwerchfell (bilateraler dAIC), zusammen mit dem Thalamus (bilateraler postreriorer / linker dAIC) und dem linken Putamen (linker dAIC) (Zamorano et al., 2019).
Das Cerebellum ist insbesondere am “Timing” und der Feinregulierung und Kontrolle der Bewegung beteiligt (Kehlkopf, Gesichtsmuskulatur, Gleichgewicht, Augenbewegung, Koordinationsgenauigkeit). Ebenso wirkt es mit an den kognitiven Funktionen und der Kontrolle von Emotionen (Serotonin- und Noradrenalin-System). Das Erlernen von Stimmfertigkeiten führt zu einer strukturellen Veränderung der Dichte der grauen Substanz im primären und sekundären somatosensorischen Cortex und im IPS. Dies spielt eine wesentliche Rolle bei der Entwicklung der Gesangskunstfertigkeit.
Zusätzlich zur Aktivität in der grauen Substanz entdeckten Wissenschaftler, dass die Nervenfasern der weißen Substanz (Fig 7a) eine wichtige Rolle bei der Verbindung derjenigen Bereiche spielen, die die Stimme betreffen. Die dorsalen Faserstränge (Fig 7b), für die sensomotorische Übertragung zuständig, werden als flexibel und indirekt beschrieben. Prämotorischer Cortex (PMC), supplementärer motorischer Cortex (SMA) und Prä-SMA sind über U-Fasern (Tonhöhe, Erkennung grammatikalischer Zusammenhänge) und dem Fasciculus longitudinalis superior (Wahrnehmung visueller Reize und Artikulation) miteinander verbunden. Der Fasciculus arcuatus verbindet die temporalen und frontalen Hirnregionen STG mit PMC und IFG (unter anderem BA44 / 45 mit BA22 – Fig 7c). Sie sind an der Hörverarbeitung und Stimmproduktion, der Rückmeldung von Kehlkopf (Intonation) und Lunge als Reaktion auf das Stimmtraining beteiligt.
Die ventralen Faserstränge (Fig 7b) sind an einer unwillkürlichen und direkten Verarbeitung beteiligt. Fasciculus longitudinalis inferior und Capsula extrema verbinden Gyrus temporalis medius mit BA44 / 45/47 und IFG für Informationen über Wort- und Zeichenbedeutung, Tonhöhen- und Melodieanalyse. Fasciculus uncinatus verbindet den orbifrontalen Cortex (OFC) mit dem vorderen Temporallappen für die Sprachverarbeitung, Gedächtnis, Emotionen und Entscheidungsfindung. Und Fasciculus longitudinalis inferior stellt eine Verbindung von Okzipitallappen zu Temporallappen her, um visuelle Objekte zu erkennen (Bashwiner, 2018).
Das Default Mode Network (DMN) und ›Imagery‹ sind zwei wichtige Netzwerke, die mit dem Singen zusammenhängen. Das DMN ist während eines Ruhezustandes oder bei Tagträumen aktiv. Es steht in Verbindung mit musikalischer Kreativität wie z.B. Improvisieren, Musizieren oder komponieren von Musik. ›Imagery‹ – das Vorstellungsvermögen – interagiert ebenfalls mit dem DMN. Es ist die erstaunliche Fähigkeit, sich die perfekte Ausführung von Musik nur durch Konzentration im Bewusstsein konkret vorzustellen. Es kombiniert u.a. auditive Verarbeitung (z. B. bilaterale BA22), sensomotorische Koordination, Gedächtniswiederherstellung (Cerebellum), kognitive Kontrolle (PFC), visuelle Bereiche und Emotionen (limbisches System). Wie beim aktiven Singen ist Imagery eine Wechselwirkung zwischen einzelnen anatomischen Gehirnstukturen und mehreren Netzwerken, einschließlich Hör-, Aufmerksamkeits- und Bewegungssteuerungsnetzwerken. (Fig 8. – Zhang et al., 2017).
Im DMN sind viele Areale miteinander verbunden. Dazu gehören: dorsomediale PFC, lateraler temporaler Cortex und Planum polare (BA38), posteriores CC, Precuneus und Gyrus angularis und der untere Parietallappen. Zusammen mit den Zentren für motorische Aktivität und Klangverarbeitung (wie dorsale PMC, SMA und BA22) und emotionsbezogenen Bereichen (OFC, BA38 und Amygdala) bildet das DMN ein hoch kreatives Netzwerk.
Neben den anatomischen Netzwerkstrukturen sind neurochemische Prozesse bei der Stimmverarbeitung entscheidend. Hirnstamm, Basalganglien und das Limbische System produzieren Neurotransmitter und Hormone, die mit den Neuronen in den Zielbereichen (Striatum, Nucleus accumbens, ACC, PFC) kommunizieren. Sie hemmen oder regen Aktivität über exitatorische glutamaterge Wege, hemmende GABAerge Wege und dopaminerge Wege an. Cerebellum und Amygdala sind wichtige Zwischenstationen der Serotonin- und Noradrenalinsysteme.
Dopamin und Opoide (ventraler tegmentaler Bereich, Substantia nigra) spielen eine entscheidende Rolle bei belohnungsbezogenen Signalen und wirken sich aus auf Motivation, Vergnügen, Aufmerksamkeitskontrolle und verstärken die Lernmotivation. Cortisol (Hypophyse) und Serotonin (Raphekerne) kontrollieren Stress und Erregung. Sie initiieren oder lindern Stressfaktoren, um kognitive Funktionen, Emotionen und unterbewusste Körperfunktionen in Einklang zu bringen. Serotonin stärkt das Immunsystem, wirkt entspannend sowie antidepressiv und fördert die Motivation. Oxytocin (Hypophyse) und endogene Opoide wie Dopamin und Vasopressin regulieren Abwehrkräfte, belohnende Signale und soziale Zugehörigkeit. Diese Wirkungen werden auch mit dem Singen in einem Chor verbunden. Ob und welche Rolle das Oxytocin genau beim Singen spielt, ist jedoch noch nicht im Detail geklärt. (Chanda, Levitin, 2013)
 Um das faszinierende Bild der neuronalen Forschung zu vervollständigen, soll hier die Humangenetik kurz erwähnt werden. Wissenschaftler fanden vielversprechende Daten, die eine Verbindung zwischen musikalischer Begabung und den Chromosomen belegen (Tan et al. 2014; Oikkonen et al. 2015). Die Gene auf den Chromosomen sind für die Produktion von Proteinen oder Rezeptoren verantwortlich, die sich mit Neurotransmittern verbinden. Dadurch lassen sich wiederum die Verbindungen zu den musikverarbeitenden Hirnregionen herstellen. Hier einige Ergebnisse: Das Gen GATA2 auf Chromosom 3q.21.3 reguliert die Entwicklung von Cochlea-Haarzellen und Colliculus inferior in der Hörbahn. Mehrere Gene auf Chromosom 4 weisen darauf hin, dass sie am Lernen von Liedern, am Gedächtnis und an der Musikwahrnehmung beteiligt sind, auch sind sie mit der Intonation beim Singen verbunden. Gene auf Chromosom 8 sind mit Lernen und Gedächtnis, absolutem Gehör und Musikwahrnehmung verknüpft. Das Gen SLC6A4 auf Chromosom 17q11.2 ist mit Belohnungssystem, musikalischem Gedächtnis und Gruppenaktivität wie Chorgesang oder Tanz verbunden. Es ist aufregend, die Genpositionen auf Chromosomen in den Genkarten der menschlichen Datenbank (z. B. genecards.org), die mit dem Singen in Verbindung gebracht werden, zu entdecken und zu erforschen.
Um das faszinierende Bild der neuronalen Forschung zu vervollständigen, soll hier die Humangenetik kurz erwähnt werden. Wissenschaftler fanden vielversprechende Daten, die eine Verbindung zwischen musikalischer Begabung und den Chromosomen belegen (Tan et al. 2014; Oikkonen et al. 2015). Die Gene auf den Chromosomen sind für die Produktion von Proteinen oder Rezeptoren verantwortlich, die sich mit Neurotransmittern verbinden. Dadurch lassen sich wiederum die Verbindungen zu den musikverarbeitenden Hirnregionen herstellen. Hier einige Ergebnisse: Das Gen GATA2 auf Chromosom 3q.21.3 reguliert die Entwicklung von Cochlea-Haarzellen und Colliculus inferior in der Hörbahn. Mehrere Gene auf Chromosom 4 weisen darauf hin, dass sie am Lernen von Liedern, am Gedächtnis und an der Musikwahrnehmung beteiligt sind, auch sind sie mit der Intonation beim Singen verbunden. Gene auf Chromosom 8 sind mit Lernen und Gedächtnis, absolutem Gehör und Musikwahrnehmung verknüpft. Das Gen SLC6A4 auf Chromosom 17q11.2 ist mit Belohnungssystem, musikalischem Gedächtnis und Gruppenaktivität wie Chorgesang oder Tanz verbunden. Es ist aufregend, die Genpositionen auf Chromosomen in den Genkarten der menschlichen Datenbank (z. B. genecards.org), die mit dem Singen in Verbindung gebracht werden, zu entdecken und zu erforschen.
Insbesondere durch das Singen sind mehr Regionen im gesamten Gehirn beteiligt und bilateral aktiv als bisher angenommen. Neuronale Netzwerke der grauen und weißen Gehirnsubstanz verknüpfen sich mit chemischen Neurotransmittersystemen und genetischer Veranlagung. Wie Zahnräder in einem riesigen Uhrwerk erzeugen sie unsere ganz persönliche, einzigartige Symphonie der Neuronen. Die Neurowissenschaften zeigen die Schönheit des menschlichen Gehirns und seine erstaunlichen Fähigkeiten. Die Ergebnisse dieses aufregenden Forschungsgebietes könnten in Zukunft krankhafte Störungen des Stimmapparates behandeln. Vielversprechende Studien untersuchen die Möglichkeit zur Wiederherstellung der Stimme durch einen künstlichen Vokaltrakt (hergestellt mittels 3D-Druck) unter Verwendung individueller Bildgebungsdaten. Dies ist ein ermutigender Ansatz für weitere Untersuchungen (Howard, 2020).
Es gibt noch viel über die Verarbeitung von Musik und Gesang im Speziellen zu entdecken. Je mehr Antworten wir bekommen, desto mehr Fragen stellen sich und gleichzeitig wächst die Faszination für das menschliche Gehirn und die Magie der Musik.
References: Text
- Albouy P., Benjamin L., Morillon, Zatorre R.J., 2020. Distinct sensitivity to spectrotemporal modulation supports brain asymmetry for speech and melody. McGill University, Montreal, Canada. doi:10.1126/science.aaz3468
- Alexander A.L., Lee J.E., Lazar M., Field A.S., 2007. Diffusion Tensor Imaging of the Brain. University of Wisconsin-Madison; New York University School of Medicine, New York USA., doi:10.1016/j.nurt.2007.05.011
- Altenmüller E., Furuya S., 2017. Apollos Gift and Curse: Making Music as a model for Adaptive and Maladaptive Plasticity. Hochschule für Musik, Theater und Medien Hannover, Germany. doi:10.1515/nf-2016-A054
- Bartol Jr. T.M., Bromer C., Kinney J., Chirillo M.A., Bourne J. N., Harris K. M., Sejnowski T.J., 2015. Nanoconnectomic upper bound on the variability of synaptic plasticity. Salk Institute for Biological Studies, La Jolla, United States. doi:10.7554/eLife.10778.001
- Bashwiner D., Bacon D., 2018. Musical creativity and the motor system. University of New Mexico, Albuquerque, United States. doi:10.1016/j.cobeha.2018.12.005
- Bashwiner D.M., Wertz C.J., Flores R.A., Jung R.E., 2015. Musical Creativity “Revealed” in Brain Structure: Interplay between Motor, Default Mode, and Limbic Networks. University of New Mexico, Albuquerque, United States. doi:10.1038/srep20482
- Benner J., Wengenroth M., Reinhardt J., Stippich C., Schneider P., Blatow M., 2017. Prevalence and function of Heschl’s gyrus morphotypes in musicians. University of Heidelberg Medical School, Germany. doi:10.1007/s00429-017-1419-x
- Butler B.E., Stephen G. Lomber S.G., 2013. Functional and structural changes throughout the auditory system following congenital and early-onset deafness: implications for hearing restoration. University of Western Ontario, Canada. doi:10.3389/fnsys.2013.00092
- Chanda M.L., Levitin D.J., 2013. The neurochemistry of music. McGill University, Montral, Canada. doi:10.1016/j.tics.2013.02.007
- Cheung V.K.M., Meyer L., Friederici A.D., Koelsch S., 2017. The right inferior frontal gyrus processes nested non-local dependencies in music. Max Planck Institut Leipzig, Germany; University of Bergen, Norway. doi:10.1038/s41598-018-22144-9
- Christiner M., Reiterer S.M., 2015. A Mozart is not a Pavarotti: Singers outperform instrumentalists on foreign accent imitation. University of Vienna, Austria. doi:10.3389/fnhum.2015.00482
- Cohen A.J., Levitin D., Kleber B.A., 2020. Brain mechanisms underlying singing. doi:10.4324/9781315163734-6
- Cole M.W., Reynolds J.R., Power J.D., Repovs G., Anticevic A., Braver T.S., 2013. Multi-task connectivity reveals flexible hubs for adaptive task control. Washington University in St. Louis, United States. doi:10.1038/nn.3470
- Corballis M.C., 2014. Left Brain, Right Brain: Facts and Fantasies. School of Psychology, University of Auckland, New Zealand. doi:10.1371/journal.pbio.1001767
- Englander Z.A., Pizoli C.E., Batrachenko A., Sun J., Worley G., Mikati M.A., Kurtzberg J., Song A.W., 2013. Diffuse reduction of white matter connectivity in cerebral palsy with specific vulnerability of long range fiber tracts. Duke University Medical Center, United States. doi:10.1016/j.nicl.2013.03.006
- Gaser C., Schlaug G., 2003. Brain structures differ between musicians and non-musicians. University Jena, Germany, Harvard Medical School, Boston United States. doi:10.1523/JNEUROSCI.23-27-09240.2003
- Goschke T., 2013. Methoden der Kognitiven Neurowissenschaft: Kurze Einführung in die funktionelle Bildgebung, ModulA1 SS 2013. TU Dresden
- Halwani G.F., Loui P., Rüber T., Schlaug G., 2011. Effects of practice and experience on the arcuate fasciculus: comparing singers, instrumentalists, and non-musicians. Harvard Medical School, Boston, United States. doi:10.3389/fpsyg.2011.00156
- Hill V.B., Cankurtaran C.Z., Liu B.P., Hijaz T.A., Naidich M., Nemeth A.J., Gastala J., Krumpelman C., McComb E.N., Korutz A.W., 2019. A Practical Review of Functional MRI Anatomy of the Language and Motor Systems. Northwestern University Feinberg School of Medicine, Chicago, United States. doi:10.3174/ajnr.A6089
- Howard D.M., 2020. Synthesis of a Vocal Sound from the 3,000 year old Mummy, Nesyamun ‘True of Voice’. Royal Holloway, University of London, United Kingdom. doi:10.1038/s41598-019-56316-y
- Jürgens U., 2009.The Neural Control of Vocalization in Mammals: A Review. German Primate Center Göttingen, Germany. doi:10.1016/j.jvoice.2007.07.005
- Kaufmann C., Auer D.P., 2002. Brain imaging in psychiatry. Psychotherapie 7. Jahrg. 2002, Bd. 7, Heft 2. CIP-Medien, München
- Kleber B., Friberge A., Zeitounic A., Zatorre R., 2016. Experience-dependent modulation of right anterior insula and sensorimotor regions as a function of noise-masked auditory feedback in singers and nonsingers. Canada, Germany, Sweden, Denmark. doi:10.1016/j.neuroimage.2016.11.059.
- Kleber B., Veit R., Birbaumer N., Gruzelier J., Lotze M., 2009. The Brain of Opera Singers: Experience- Dependent Changes in Functional Activation. Germany, Italy, United Kingdom. doi:10.1093/cercor/bhp177
- Kleber B.A., Zarate J.M., 2014. The neuroscience of singing. Oxford University Press, Oxford, United Kingdom. doi:10.1093/oxfordhb/9780199660773.013.015
- Koelsch S., 2012. Brain and Music. John Wiley & Sons Ltd., Chichester, United Kingdom. ISBN: 978-0-470-68339-2
- Kolb, B., Muhammad, A., Gibb, R., 2010. Searching for factors underlying cerebral plasticity in the normal and injured brain, Journal of Communication Disorders. University of Lethbridge, Canada. doi:10.1016/j.jcomdis.2011.04.007
- Loui P., 2015. A dual-stream neuroanatomy of singing. Wesleyan University, Universitiy of California Press, United States. doi:10.1525/MP.2015.32.3.232
- Luo N., Sui J., Abro A., Turner J.A., Damara E., Fu Z., Fan L., Chen J., Lin D., Zhuo C., Xu Y., Glahn D.C., Rodrigue A.L., Banich M.T., Pearlson G.D., Calhoun V.C., 2019. Structural brain architectures match intrinsic functional networks and vary across domains: A study from 15000+ individuals. China, United States. doi:10.1101/2019.12.17.879502
- Martínez-Molina N., Mas-Herrero E., Rodríguez-Fornells A., Robert J. Zatorre R.J., Marco-Pallerés J., 2019. White matter microstructure reflects individual differences in music reward sensitivity. Universitiy of Barcelona, Spain; McGill University, Canada. doi:10.1523/JNEUROSCI.2020-18.2019
- Oikkonen J., Huang Y., Onkamo P., Ukkola-Vuoti L., Raijas P., Karma K., Vieland V.J., Järvelä I., 2015. A genome-wide linkage and association study of musical aptitude identifies loci containing genes related to inner ear development and neurocognitive functions. Univerity of Helsinki, Finland. doi:10.1038/mp.2014.8
- Oxenham A.J., 2018. How we hear: The perception and neural coding of sound. University of Minnesota, United States. doi:10.1146/annurev-psych-122216-011635
- Patel A.D., 2007. Music, language and the brain. Oxford University Press NewYork, United States. doi:10.1093/acprof:oso/9780195123753.001.0001
- Poeppel D., 2003.The analysis of speech in different temporal integration windows: Cerebral lateralization as ‘asymmetric sampling in time’. New York University, United States. doi:10.1016/S0167-6393(02)00107-3
- Segado M., Hollinger A., Thibodeau J., Penhune V., Zatorre R.J., 2018 Partially Overlapping Brain Networks for Singing and Cello Playing. Concordia University Montreal, Canada. doi:10.3389/fnins.2018.00351
- Simonyan K., Barry Horwitz B., 2011. Laryngeal Motor Cortex and Control of Speech in Humans. Mount Sinai School of Medicine New York, United States. Neuroscientist 2011. April; 17(2): 197–208. doi:10.1177/1073858410386727
- Steel C.J., Zatorre R.J., 2018. Practice makes plasticity. Max Planck Institute, Leipzig Germany; McGill University, Montreal, Canada. doi:10.1038/s41593-018-0280-4
- Takahashi T., Suzuki M., Kurachi M., 2010. A follow-up MRI study of the superior temporal subregions in schizotypal disorder and first-episode schizophrenia. Schizophrenia Research. Volume 119, Issues 1–3, June 2010, Pages 65-74. Corpus ID: 26117184. doi:10.1016/j.schres.2009.12.006
- Tan Y.T., McPherson G.E., Peretz I., Berkovic S.F., Wilson S.J., 2014. The genetic basis of music ability. University of Melburne, Australia. doi:10.3389/fpsyg.2014.00658
- Toga A.W., Thompson P.M., 2003. Mapping brain asymmetry. UCLA School of Medicine, Los Angeles, United States. doi:10.1038/nrn1009
- Wang W., Wie L., Chen N., Jones J.A., Gong G., Liu H., 2019 Decreased Gray-Matter Volume in Insular Cortex as a Correlate of Singers’ Enhanced Sensorimotor Control of Vocal Production. University Guangzhou; Beijing Normal University, China; Wilfrid Laurier University, Canada. doi:10.3389/fnins.2019.00815
- Zamorano A.M., Zatorre R.J., Vuust P., Friberg A., Birbaumer N., Kleber B., 2019. Enhanced insular connectivity with speech sensorimotor regions in trained singers – a resting-state fMRI study. Germany, Switzerland, Denmark, Spain, Canada, Sweden. doi:10.1101/793083
- Zhang Y., Chen G., Wen H., Lu K., Liu Z., 2017. Musical Imagery Involves Wernicke’s Area in Bilateral and Anti-Correlated Network Interactions in Musicians. Purdue University, West Lafayette, United States. doi:10.1038/s41598-017-17178-4

 Margarete M. Ertl, Landshut, Deutschland
Margarete M. Ertl, Landshut, Deutschland
Musik und Singen begleiten sie seit Ihrer Kindheit. Mehr als 25 Jahre Erfahrung als Dirigentin und Stimmbildnerin für Sänger jeden Alters. Gründung einer eigenen unabhängigen Sing- und Chorschule. Ihre Erfahrung inspiriert Menschen dazu, offen zu sein und neue musikalische Wege zu gehen. Organisatorin internationaler Chöre-Treffen, um anderen Kulturen und der Chorwelt zu begegnen, begeistert von Kunst im allgemeinen und Wissenschaft im speziellen.
- Teilnehmerin an Internationalen Meisterkursen im Dirigieren
- Präsentation auf der Community Music Conference Munich 2015: »Aufbau eines Konzertkinderchores basierend auf der Communitiy Musik-Philosophie – Widerspruch oder Bestätigung – ein Erfahrungsbericht«.
- Teilnahme an den »World Symposien on Choral Music« (WSCM) seit 1999
- Teilnahme mit Auszeichnungen an internationalen Chorwettbewerben
- Abgeschlossene Ausbildung zur Gesangspädagogin in Fulda, Deutschland
- Abgeschlossene Ausbildung als Kinderchorleiterin und Chorleiterin in Wolfenbüttel, Deutschland
Kontakt: margarete.ertl@icloud.com
[1] Die synaptische Plastizität betrifft die Verbindung der Neuronen untereinander an den Synapsen. Man unterscheidet dabei zwischen »funktioneller Plastizität«: Änderung der Übertragungsfrequenz bzw. Quantität von Neurotransmittern und der Rezeptordichte um bestehende synaptische Verbindungen zu stärken oder zu schwächen und »struktureller Plastizität«: Änderungen in Morphologie, Anzahl und Organisation der Synapsen.





