La neurociencia y la música: un vistazo al cerebro humano y la magia de la música
 Margarete M. Ertl, Alemania
Margarete M. Ertl, Alemania
Directora y profesora de canto
Este artículo está basado en una conferencia que habría sido parte del 22do Simposio Mundial de Música Coral en Auckland, Nueva Zelanda. Como el Simposio tuvo que ser cancelado, el Boletín Coral Internacional les ofrece aquí la posibilidad de echar un vistazo al tema por medio de una versión escrita.
Echen un vistazo al fascinante mundo de la neurociencia y adquieran una nueva percepción de la sinfonía neuronal. Las primeras percepciones de los “elementos musicales” ya estimulan el cerebro humano desde antes de nacer. Con cada percepción musical, ensayo y concierto; los directores, compositores y cantantes trabajan en su red neuronal personal.
Al cantar, el cerebro humano procesa más que la sintaxis verbal y musical. Controla funciones corporales involuntarias; los movimientos del tracto vocal, de los ojos y de las extremidades; y la postura. Corrige y afina los músculos gracias a señales sensoriales, visuales y auditivas. Al mismo tiempo, memoriza, anticipa, calcula, soluciona, se enfoca y procesa las señales visuales de la partitura y el director. Controla constantemente la respiración y la voz de acuerdo con el tono, timbre, compás, tempo, ritmo, elementos espectrales como las vocales y consonantes en varios idiomas. Aprende y recuerda comentarios y exigencias relacionadas con la expresión musical. El cantante está interactuando con otros músicos no solo musicalmente, sino también emocionalmente y socialmente; se combina con las otras voces teniendo en cuenta los requerimientos acústicos. El oído está permanentemente alerta, se enfoca en su propia producción vocal y en todos los sonidos a su alrededor, y analiza los sonidos en orden jerárquico de atención. Además, los procesos químicos guían simultáneamente las sensibilidades y emociones personales. Para lograr esta habilidad, se requiere de una red neuronal altamente compleja.
Este artículo resume el estado actual de los hallazgos en estudios enfocados en el campo del canto, un viaje deslumbrante hacia la magia de la música: echarán un vistazo, en primer lugar, al cerebro humano y su sistema nervioso. Este informe presenta, además, las técnicas de neuroimagen funcional que mapea las actividades en las diferentes estructuras del cerebro humano durante el complejo procesamiento vocal. El tema final ilustra la anatomía del cerebro y abre una ventana hacia las cautivantes áreas de estudio de investigaciones recientes. Mostraré los procesos neuronales e interaccionales en varias regiones del cerebro que intervienen en el canto de acuerdo con los hallazgos de investigadores renombrados.
La investigación neurocientífica descifra el procesamiento neuronal paso a paso a través de diagnósticos de última generación y revela detalles fascinantes de la sinfonía neuronal en nuestro cerebro activo mientras canta, piensa en música y la escucha. Durante mucho tiempo, la investigación neuronal sobre el procesamiento musical se enfocó en los instrumentistas. En años recientes, los investigadores descubrieron la voz cantada, siendo su alta complejidad un objeto de creciente interés investigativo.
Alrededor de 80 mil millones de neuronas se comunican entre sí incesantemente. Los impulsos eléctricos y los procesos químicos interactúan con la materia gris (neuronas y células gliales) y la materia blanca (axones mielinizados). La estructura-densidad cerebral se incrementa con la excitación eléctrica o química o se degenera cuando no está en uso. Los impulsos eléctricos pueden hacerse audibles con la “técnica de fijación en parche de membrana”. De esta manera, los científicos pueden realizar ambas, recolectando datos y escuchando la sinfonía neuronal en tiempo real. Nuestro cerebro no solo está procesando información, sino que es, de alguna forma, la música misma o está materializando nuestros pensamientos “cantando”.
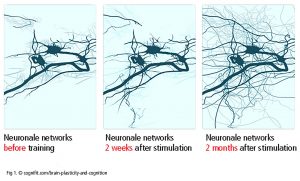
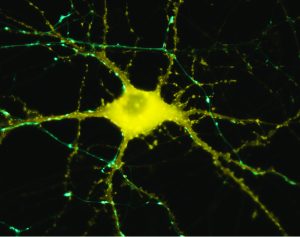
Las neuronas regulan todo, desde el sistema nervioso autónomo hasta la cognición y guía un gran número de redes entre zonas del cerebro (Luo et al., 2019). La comunicación entre las neuronas en las sinapsis se refiere a la plasticidad sináptica. Las neuronas, axones y células gliales se comunican con otras neuronas en el punto de origen o en el área destino (plasticidad neuronal – Fig 1). Una neurona puede entretejerse con hasta 10 000 neuronas, hasta 1000 terabites de capacidad en total (Bartol et al., 2015). Asimismo, los astrocitos y microglías están implicados en los procesos de reparación y sirven de intermediario en el intercambio de información entre neuronas. La plasticidad sináptica y neuronal está bien documentada. No es claramente concluyente si el cerebro humano adulto es capaz de desarrollar nuevas neuronas (la “neurogénesis” que ocurre en la zona subventricular, el cuerpo estriado y el hipocampo).
Korbinian Brodmann fue un pionero en mapear el cerebro humano. En 1909, reconoció 52 áreas histológicas diferentes en el cerebro (Áreas de Brodmann), pero solo pudo estudiar cerebros patológicos. En la actualidad, las modernas técnicas de neuroimagen funcional permiten echar un vistazo al cerebro activo vivo. Dos participantes prominentes en el estudio de imágenes fueron Herbert von Karajan y Rénee Fleming. Karajan tuvo varias oportunidades en los setenta para ayudar a recolectar datos mientras dirigía (Müller, 2005). En 2017, Fleming estaba fascinado por participar en estudios por IRMf para descubrir lo que ocurre en la red cerebral mientras cantamos a nivel profesional.
De acuerdo con la configuración de los estudios, los datos recopilados de la técnica de imagen seleccionada fueron convertidos, reproducidos y coloreados para dar como resultado fotos impresionantes que muestran las regiones de interés (RDI). La electroencefalografía (EEG) y la magnetoencefalografía (MEG) son las técnicas de imagen no invasivas más comúnmente empleadas para estudiar las regiones que muestran actividad en la materia gris mientras cantamos. La EEG solo puede llegar a estructuras en la superficie del cerebro y posee una baja resolución espacial. Sin embargo, detecta cambios en la actividad eléctrica en tiempo real, casi a nivel de milisegundos. La MEG, con resolución similar a la EEG, se utiliza para medir los campos magnéticos producidos por la actividad eléctrica cerebral.
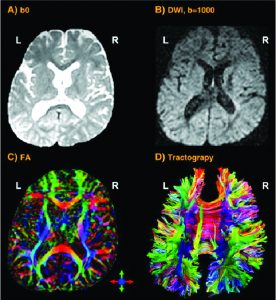
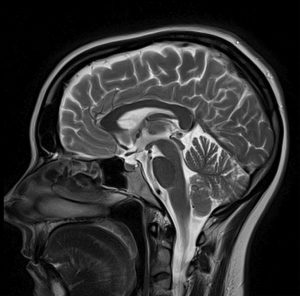
Cuando la investigación se concentra en el grosor cortical de la materia gris o en el tamaño o tractos de las fibras de la materia blanca, las técnicas de imagen con mayor resolución espacial son necesarias. La imagen por resonancia magnética (IRM – Fig 2a) y la IRM funcional (IRMf) se usan con frecuencia en estos casos. Ellas visualizan las estructuras anatómicas del cerebro, incluso en áreas subcorticales. El método detecta los cambios en la oxigenación y el flujo de la sangre en respuesta a la actividad neuronal. La imagen de contraste dependiente del nivel de oxígeno en la sangre (BOLD por sus siglas en inglés) es un método específico de la IRMf, que utiliza las diferentes propiedades magnéticas de la desoxihemoglobina y oxihemoglobina para medir la actividad vocal en áreas del cerebro relacionadas.
La excitación incrementada activa los oligodendrocitos para moldear la capa de mielina alrededor del axón (fibra nerviosa). Por lo tanto, el potencial de acción cambia desde la conducción continua a lo largo del axón hasta la conducción saltatoria de un área amielínica (nodo de Ranvier) hasta la próxima. Esto acelera la transmisión de impulsos eléctricos. Un oligodendrocito puede mielinizar hasta 50 neuronas en el proceso de aprendizaje o cuando restaura conexiones rotas. Los oligodendrocitos también pueden desmielinizar axones para suprimir información y despejar conexiones. La imagen con tensor de difusión (ITD – Fig 2b) detecta las fibras en gran detalle. Como la IRM e IRmf, la ITD no es invasiva y utiliza el movimiento direccional único de las moléculas de agua, a lo largo de los tractos nerviosos, para identificar los vínculos y estructuras de las fibras de materia blanca con baja resolución temporal.
Otras herramientas no invasivas para recolectar datos prometedores en investigaciones sobre la voz son: la espectroscopia por resonancia magnética (que mide los procesos bioquímicos en un potente campo magnético); las técnicas de imagen por microscopía 3D de alta resolución (Fig 2c), que permiten un escaneo preciso del espécimen en un rango nanómetrico o subnanométrico; la tomografía computarizada de emisión monofotónica (SPECT) y la tomografía por emisión de positrones (PET) utilizan material radiactivo de vida corta. A pesar de su baja resolución, ambos métodos mapean los procesos funcionales efectivamente midiendo el flujo sanguíneo. Las áreas de alta radiactividad están asociadas con la alta actividad cerebral en las regiones subcorticales.
Cada método de imagen posee ventajas y desventajas. Si resumimos los resultados de cada enfoque diferente y las RDI, aumentamos la comprensión del procesamiento neuronal al cantar.
La característica anatómica principal del cerebro humano consiste en la estructura por pliegues y ambos hemisferios, conectados por el cuerpo calloso. Las distintas técnicas de imagen verifican una lateralización. Eso quiere decir que los hemisferios poseen áreas que se encargan de procesar diferentes tareas. Algunas están más orientadas hacia la izquierda o la derecha o están equilibradas. El hemisferio izquierdo se especializa en el procesamiento temporal rápido mientras que el hemisferio derecho se especializa en el procesamiento temporal lento (Poeppel, 2003).
Las áreas musicales y del habla son ejemplos bien conocidos de lateralización. Estas pasan entre las áreas de procesamiento del lenguaje del hemisferio izquierdo y derecho y también las comparten. La producción del lenguaje y algunos aspectos del procesamiento sintáctico están ubicados principalmente en las áreas del hemisferio izquierdo anterior, que incluyen el área de Broca (BA44/45). La comprensión lingüística está confinada principalmente en la región temporal-parietal posterior izquierda, que incluye el área de Wernicke (BA22). El planum temporale izquierdo es hasta diez veces más grande en el cerebro humano que su homólogo derecho (es un área sensible para la percepción del tono como parte de BA22). El área de Broca muestra un volumen mayor en el hemisferio derecho. Asimismo, se revela que el surco central, que alberga la corteza motora principal (M1- tracto vocal), es más profundo y grande en el hemisferio derecho (Corballis, 2014; Toga et al., 2003; Albouy et al., 2020).
© Butler B., 2013
Un hallazgo inesperado en la investigación es que una corteza o manojo de fibras blancas más grueso no implica una ventaja en general como tal entre no músicos y músicos. Luego de prácticas a largo plazo, las áreas del cerebro se utilizan más eficientemente y la afinación de los músculos en el procesamiento vocal alcanzan una alta realimentación sensorial. Esto se puede medir en algunas áreas como una estructura física más gruesa, aunque no de forma implícita. Se asume que una red de sinapsis con una mayor densidad por neurona y un mayor número de densidad de células gliales intervienen en este procesamiento más efectivo(Gaser, Schlaug, 2003).
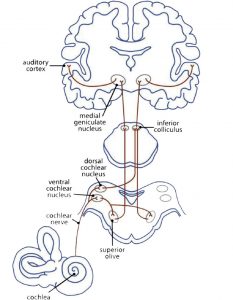
A primera vista, la música está conectada al sentido del oído. La mielinización de los axones en la corteza auditiva ya empieza en el vientre de la madre en el último trimestre del embarazo. La red neuronal auditiva (Fig 3a) empieza con un impulso mecánico que llega al tímpano. El fluido de la cóclea pasa el impulso hacia las células pilosas externas e internas del órgano de Corti, los estereocilios. Estos cambian su posición y emiten un impulso a sus células radicales. Los transmisores químicos se vuelcan en la brecha sináptica para abrir canales de Ca2+. Esto evoca un impulso eléctrico hacia la vía auditiva: desde los núcleos cocleares hasta el complejo olivar superior, el colículo inferior y el núcleo geniculado medial (tálamo), hasta la corteza auditiva primaria (A1) en el giro temporal superior (T1). Aquí, el impulso pasa hacia las redes que analizan la información del sonido (Cheung et al., 2017).
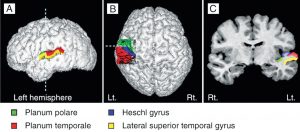
El área de Heschl (HG) corresponde a la corteza auditiva (Fig 3b). Está estrechamente relacionada con la percepción sonora; y su morfología en cuanto a la forma, tamaño y asimetría también influye en el desempeño musical. Una HG derecha más grande indica una preferencia en el procesamiento de tono espectral, donde el sonido es desglosado en diferentes componentes. La preferencia en el tono fundamental para percibir el sonido como un todo hace que la HG izquierda sea más grande (Brenner, Schneider et al., 2017). Esto está bien documentado en el caso de los instrumentistas. Se requieren de más investigaciones para examinar la diferencia en el procesamiento entre el tono espectral y fundamental en la HG en el caso de los cantantes y cuán lejos podría influir este aspecto en el sonido de un coro.
Las estructuras cerebrales de cantantes e instrumentistas son significativamente diferentes. Al contrario de los instrumentistas, el instrumento de los cantantes, la voz, es parte de su cuerpo. La voz crece y envejece, y es usada permanentemente para el habla y el canto. Los cantantes no solo dependen de la realimentación auditiva, sino también de la realimentación sensomotora durante el procesamiento de la producción vocal. Basado en la creciente experiencia en canto a lo largo de toda una vida de aprendizaje, ellos muestran una materia gris más gruesa en las áreas auditivas (por ejemplo, en el área de Heschl), las áreas motoras (por ejemplo, el área motora suplementaria – AMS) o el cerebelo. Además, la densidad de la materia blanca en las fibras comisurales o fibras de asociación es mayor y su volumen en el hemisferio izquierdo es mayor que en los instrumentistas (Loui, 2015; Schlaug et al., 2011).
La corteza cerebral se divide en lóbulo frontal, temporal, parietal y occipital con sus veintisiete surcos y dieciséis giros, el cerebelo y el tallo cerebral (Fig 4). La corteza cerebral cubre otras estructuras internas, las cuales incluyen el sistema límbico, los ganglios basales y las fibras de materia blanca. Las fibras comisurales (cuerpo calloso, fórnix) dirigen la transferencia de información y la conexión entre los hemisferios. Las fibras de asociación (fascículo arqueado/ fascículo longitudinal) conectan las regiones cerebrales a lo largo y profundo del mismo hemisferio. Las fibras de proyección son la conexión a la espina dorsal. Estas estructuras responden al canto de manera directa o secondaria.
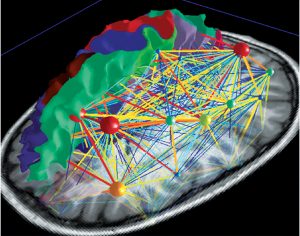
El control deliberado en la producción motora vocal para el habla o el canto activa una red altamente compleja que se organiza jerárquicamente y puede visualizarse como un mapa (Fig 5a). Existen dos ejes principales que conectan nodos con diferentes niveles de importancia. De esta manera, la red neuronal va desarrollándose en un mapa cerebral individual personal y absoluto (Fig 5b). Obtener un panorama completo de esta compleja red supone un desafío, pero es asombroso desenredar un sector tras otro (atlas.brainnetome.org/bnatlas.html).
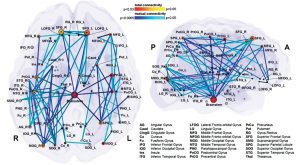
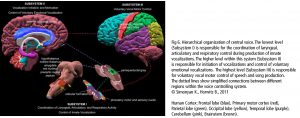
La red central en el canto es la red de control vocal jerárquicamente organizada. El córtex del cíngulo anterior (CCA, un eje importante en procesamiento musical), el lóbulo parietal inferior y occipital, parte del sistema límbico y la sustancia gris central en el mesencéfalo del tallo cerebral (Fig 6) son las áreas esenciales. Ellas pasan la información a las motoneuronas fonatorias a las que se les atribuye la disposición o iniciación de la vocalización (Jürgens, 2009). Estas regiones se conectan con la red a la que se le atribuye el aprendizaje de la vocalización, el cual consiste en la corteza motora principal en el lóbulo frontal y las regiones que afinan el programa vocal desde la corteza motora: el putamen, el globo pálido, el puente troncoencefálico (pons) y el cerebelo. El programa afinado es enviado de regreso a la M1 a través del tálamo. Además, existen varias regiones neuronales de la vía auditiva involucrada (como se describe más arriba). Durante la comparación tonal en notas individuales y melodías, se alistan las áreas corticales dentro y fuera del lóbulo temporal en las áreas de la corteza auditiva y el lóbulo frontal. El timbre vocal se procesa en el surco temporal superior (STS) dentro del lóbulo temporal: el surco temporal superior anterior (STSa – reconocimiento de la voz), el STS medio y anterior (característica espectral de la voz, comparación entre sonido y ruido), el STS posterior (STSp – identificación de voces desconocidas). El circuito somatosensorial, junto con el surco intraparietal (SIP) y la corteza premotora dorsal, prepara la producción sensorial para la preparación motora. La realimentación para el sentido del movimiento y posición (respiratorio, laríngeo) es procesada en la corteza somatosensorial primaria (S1) del lóbulo parietal y la ínsula. (Kleber, Zarate, 2014). La CCA, el STSp, el SIP, la corteza insular anterior y el cerebelo interactúan con el control motor y cortical de una vocalización compleja.
La corteza insular anterior (CIA) y el cerebelo son ejes importantes para el procesamiento de la voz y se deben estudiarlos con mayor detalle. Su papel esencial en el canto ocurre en la laringe (dorsal izquierdo de la CIA) y el diafragma (CIAd bilateral) junto con el tálamo (CIAd bilateral posterior/izquierda) y el putamen izquierdo (CIAd izquierdo) (Zamorano et al., 2019). El cerebelo participa específicamente en el tiempo y la regulación fina del control motor (laringe, músculos faciales, equilibrio, movimiento ocular, precisión en la coordinación). También está activo en funciones cognitivas y en el control emocional (rutas de serotonina y noradrenalina). El aprendizaje de habilidades vocales causa cambios estructurales en la densidad de la materia gris en la corteza somatosensorial primaria y secundaria y el SIP en relación con la experiencia. Esta desempeña un papel esencial en el desarrollo de la habilidad cantante.
Además de la actividad de la materia gris, los científicos descubrieron que las fibras de la materia blanca desempeñan un papel importante en la conexión de las áreas relacionadas con la voz. Se describe la vía dorsal (Fig 7b) para la traducción sensorial y motora como flexible e indirecta. La corteza premotora (CPM), el área motora suplementaria (AMS) y la preAMS se interconectan a través de las fibras en U (tono, secuencia gramatical) y el fascículo longitudinal superior (enfoca la atención en el espacio visual, cumple una función en los componentes articulatorios del lenguaje). El fascículo arqueado conecta la región temporal y la región frontal, el giro temporal superior con el núcleo de Barrington y el giro frontal inferior (entre otros, BA44/45 con BA22 – Fig 7c). Intervienen en la producción auditiva y vocal, la realimentación de la laringe (precisión de canto) y los pulmones en respuesta al entrenamiento vocal.
La vía ventral (Fig 7b) interviene en el procesamiento más automático y directo. El fascículo longitudinal inferior junto con el sistema fibroso de la cápsula extrema conecta el giro temporal medio con BA44/45/47 y el GFI en la información semántica lexical y el análisis de tono y melodía. El fascículo uncinado vincula la corteza orbitofrontal (COF) al lóbulo temporal anterior para el procesamiento vocal, la memoria, las emociones y la toma de decisiones. Finalmente, el fascículo longitudinal inferior une el lóbulo occipital al lóbulo temporal para identificar objetos visuales (Bashwiner, 2018).
La red neuronal por defecto (RND) y la visualización son dos redes importantes en correlación con el canto. La RND está activa durante el reposo despierto o cuando la mente divaga. Está relacionado con la creatividad musical al improvisar, interpretar o componer música. La visualización interactúa igualmente con la RND. Es una habilidad asombrosa para reflexionar en la música solo de manera mental, enfocándose directamente en tareas relacionadas. Combina el procesamiento auditivo (BA22 bilateral), la coordinación sensorial y motora, la recuperación de la memoria (cerebelo), el control cognitivo (corteza prefrontal), las áreas visuales y la emoción (sistema límbico). Tal como en la producción vocal, la visualización es una interacción entre las áreas corticales y las múltiples redes, que incluyen las redes auditivas, de atención y control motora. (Fig 8. – Zhang et al., 2017). La RND vincula la CPF dorsal media, la corteza temporal lateral y el polo temporal (BA38), la corteza cingulada posterior, la precuña y el giro angular, así como el lóbulo parietal inferior. Junto con los ejes de la actividad motora y el procesamiento sonoro (como la PMC dorsal, AMS y BA22) y las áreas relacionadas con las emociones (COF, BA38 y la amígdala), la RND forma un flujo de trabajo altamente creativo.
Debajo de las estructuras de redes anatómicas, los procesos neuroquímicos se interrelacionan con el procesamiento vocal. El tallo cerebral, los ganglios basales y el sistema límbico producen neurotransmisores y hormonas, los cuales se comunican con las neuronas en las áreas del cerebro destino (cuerpo estriado, núcleo accumbens, CCA, CPF). Estos inhiben o exhiben actividad mediante rutas glutamatérgicas excitatorias, rutas GABAérgicas inhibitorias y rutas dopaminérgicas. El cerebelo y la amígdala son partes importantes de las rutas de serotonina y de noradrenalina para acentuar la respuesta como recompensa. La dopamina y los opioides (área tegmental ventral, sustancia negra) desempeñan un papel crucial en los comportamientos relacionados con la recompensa como la motivación, el placer, el control de la atención y refuerzan, además, el aprendizaje. Se revela que el cortisol (glándula pituitaria) y la serotonina (núcleos del rafé) controlan el estrés y la excitación. Inician o disminuyen los estresores con el fin de hacer compatibles la función cognitiva, la emoción y las funciones corporales involuntarias. La serotonina estimula el sistema inmunitario, relaja, tiene un efecto antidepresivo y promueve la motivación. La oxitocina (glándula pituitaria) y los opioides endógenos como la dopamina y vasopresina regulan la inmunidad, la recompensa y la afiliación social; de manera que cantar en un coro supuestamente intercede en los efectos sociales. Todavía no se conoce detalladamente el papel exacto de la oxitocina en el canto. (Chanda, Levitin, 2013)
 Para completar este panorama, es necesario mencionar brevemente el campo de investigación sobre nuestros genes. Los científicos hallaron datos prometedores para vincular la aptitud musical y los cromosomas (Tan et al. 2014; Oikkonen et al. 2015). Los genes en los cromosomas se encargan de la producción de proteínas o receptores que se fusionan con los neurotransmisores. El vínculo con las áreas del cerebro es detectado por estos. He aquí algunos hallazgos: el gen GATA2 en el cromosoma 3q.21.3 regula el desarrollo de las células ciliadas de la cóclea y el colículo inferior en la vía auditiva. Al parecer, múltiples genes en el cromosoma 4 intervienen en el aprendizaje musical, la memoria, la percepción musical y están asociados con la precisión en el canto. Los genes en el cromosoma 8 están conectados con el aprendizaje y la memoria, el oído absoluto y la percepción musical. El gen SLC6A4 en el cromosoma 17q11.2 está asociado a la búsqueda de la recompensa, la memoria musical y las actividades en grupo como cantar en un coro o bailar. Es impresionante poder seguir de cerca la posición de los genes en los cromosomas en bases de datos de genes humanos (genecards.org) de acuerdo con su contribución en el canto.
Para completar este panorama, es necesario mencionar brevemente el campo de investigación sobre nuestros genes. Los científicos hallaron datos prometedores para vincular la aptitud musical y los cromosomas (Tan et al. 2014; Oikkonen et al. 2015). Los genes en los cromosomas se encargan de la producción de proteínas o receptores que se fusionan con los neurotransmisores. El vínculo con las áreas del cerebro es detectado por estos. He aquí algunos hallazgos: el gen GATA2 en el cromosoma 3q.21.3 regula el desarrollo de las células ciliadas de la cóclea y el colículo inferior en la vía auditiva. Al parecer, múltiples genes en el cromosoma 4 intervienen en el aprendizaje musical, la memoria, la percepción musical y están asociados con la precisión en el canto. Los genes en el cromosoma 8 están conectados con el aprendizaje y la memoria, el oído absoluto y la percepción musical. El gen SLC6A4 en el cromosoma 17q11.2 está asociado a la búsqueda de la recompensa, la memoria musical y las actividades en grupo como cantar en un coro o bailar. Es impresionante poder seguir de cerca la posición de los genes en los cromosomas en bases de datos de genes humanos (genecards.org) de acuerdo con su contribución en el canto.
Hay más regiones en todo el cerebro que están involucradas y activadas bilateralmente por el canto específicamente de las que se esperaban anteriormente. Múltiples redes neuronales en la materia gris y blanca se entremezclan con rutas químicas y la predisposición genética. Como los engranajes de un enorme reloj, crean una sinfonía neuronal. La neurociencia muestra la belleza del cerebro humano y sus impresionantes habilidades. Los resultados de este apasionante campo de investigación podría tratar la discapacidad que afecta el tracto vocal. Estudios prometedores exploran la recuperación de la voz a través de tractos vocales artificiales impresos en 3D utilizando datos individuales de imágenes. Este es un intento alentador para más investigaciones (Howard, 2020).
Sin embargo, aún hay mucho por descubrir sobre el procesamiento del canto. Mientras más respuestas obtengamos, surgirán más preguntas y, al mismo tiempo, crecerá la fascinación por el cerebro humano y la magia de la música.
Referencias:
- Albouy P., Benjamin L., Morillon, Zatorre R.J., 2020. Distinct sensitivity to spectrotemporal modulation supports brain asymmetry for speech and melody. McGill University, Montreal, Canada. doi:10.1126/science.aaz3468
- Alexander A.L., Lee J.E., Lazar M., Field A.S., 2007. Diffusion Tensor Imaging of the Brain. University of Wisconsin-Madison; New York University School of Medicine, New York USA., doi:10.1016/j.nurt.2007.05.011
- Altenmüller E., Furuya S., 2017. Apollos Gift and Curse: Making Music as a model for Adaptive and Maladaptive Plasticity. Hochschule für Musik, Theater und Medien Hannover, Germany. doi:10.1515/nf-2016-A054
- Bartol Jr. T.M., Bromer C., Kinney J., Chirillo M.A., Bourne J. N., Harris K. M., Sejnowski T.J., 2015. Nanoconnectomic upper bound on the variability of synaptic plasticity. Salk Institute for Biological Studies, La Jolla, United States. doi:10.7554/eLife.10778.001
- Bashwiner D., Bacon D., 2018. Musical creativity and the motor system. University of New Mexico, Albuquerque, United States. doi:10.1016/j.cobeha.2018.12.005
- Bashwiner D.M., Wertz C.J., Flores R.A., Jung R.E., 2015. Musical Creativity “Revealed” in Brain Structure: Interplay between Motor, Default Mode, and Limbic Networks. University of New Mexico, Albuquerque, United States. doi:10.1038/srep20482
- Benner J., Wengenroth M., Reinhardt J., Stippich C., Schneider P., Blatow M., 2017. Prevalence and function of Heschl’s gyrus morphotypes in musicians. University of Heidelberg Medical School, Germany. doi:10.1007/s00429-017-1419-x
- Butler B.E., Stephen G. Lomber S.G., 2013. Functional and structural changes throughout the auditory system following congenital and early-onset deafness: implications for hearing restoration. University of Western Ontario, Canada. doi:10.3389/fnsys.2013.00092
- Chanda M.L., Levitin D.J., 2013. The neurochemistry of music. McGill University, Montral, Canada. doi:10.1016/j.tics.2013.02.007
- Cheung V.K.M., Meyer L., Friederici A.D., Koelsch S., 2017. The right inferior frontal gyrus processes nested non-local dependencies in music. Max Planck Institut Leipzig, Germany; University of Bergen, Norway. doi:10.1038/s41598-018-22144-9
- Christiner M., Reiterer S.M., 2015. A Mozart is not a Pavarotti: Singers outperform instrumentalists on foreign accent imitation. University of Vienna, Austria. doi:10.3389/fnhum.2015.00482
- Cohen A.J., Levitin D., Kleber B.A., 2020. Brain mechanisms underlying singing. doi:10.4324/9781315163734-6
- Cole M.W., Reynolds J.R., Power J.D., Repovs G., Anticevic A., Braver T.S., 2013. Multi-task connectivity reveals flexible hubs for adaptive task control. Washington University in St. Louis, United States. doi:10.1038/nn.3470
- Corballis M.C., 2014. Left Brain, Right Brain: Facts and Fantasies. School of Psychology, University of Auckland, New Zealand. doi:10.1371/journal.pbio.1001767
- Englander Z.A., Pizoli C.E., Batrachenko A., Sun J., Worley G., Mikati M.A., Kurtzberg J., Song A.W., 2013. Diffuse reduction of white matter connectivity in cerebral palsy with specific vulnerability of long range fiber tracts. Duke University Medical Center, United States. doi:10.1016/j.nicl.2013.03.006
- Gaser C., Schlaug G., 2003. Brain structures differ between musicians and non-musicians. University Jena, Germany, Harvard Medical School, Boston United States. doi:10.1523/JNEUROSCI.23-27-09240.2003
- Goschke T., 2013. Methoden der Kognitiven Neurowissenschaft: Kurze Einführung in die funktionelle Bildgebung, ModulA1 SS 2013. TU Dresden
- Halwani G.F., Loui P., Rüber T., Schlaug G., 2011. Effects of practice and experience on the arcuate fasciculus: comparing singers, instrumentalists, and non-musicians. Harvard Medical School, Boston, United States. doi:10.3389/fpsyg.2011.00156
- Hill V.B., Cankurtaran C.Z., Liu B.P., Hijaz T.A., Naidich M., Nemeth A.J., Gastala J., Krumpelman C., McComb E.N., Korutz A.W., 2019. A Practical Review of Functional MRI Anatomy of the Language and Motor Systems. Northwestern University Feinberg School of Medicine, Chicago, United States. doi:10.3174/ajnr.A6089
- Howard D.M., 2020. Synthesis of a Vocal Sound from the 3,000 year old Mummy, Nesyamun ‘True of Voice’. Royal Holloway, University of London, United Kingdom. doi:10.1038/s41598-019-56316-y
- Jürgens U., 2009.The Neural Control of Vocalization in Mammals: A Review. German Primate Center Göttingen, Germany. doi:10.1016/j.jvoice.2007.07.005
- Kaufmann C., Auer D.P., 2002. Brain imaging in psychiatry. Psychotherapie 7. Jahrg. 2002, Bd. 7, Heft 2. CIP-Medien, München
- Kleber B., Friberge A., Zeitounic A., Zatorre R., 2016. Experience-dependent modulation of right anterior insula and sensorimotor regions as a function of noise-masked auditory feedback in singers and nonsingers. Canada, Germany, Sweden, Denmark. doi:10.1016/j.neuroimage.2016.11.059.
- Kleber B., Veit R., Birbaumer N., Gruzelier J., Lotze M., 2009. The Brain of Opera Singers: Experience- Dependent Changes in Functional Activation. Germany, Italy, United Kingdom. doi:10.1093/cercor/bhp177
- Kleber B.A., Zarate J.M., 2014. The neuroscience of singing. Oxford University Press, Oxford, United Kingdom. doi:10.1093/oxfordhb/9780199660773.013.015
- Koelsch S., 2012. Brain and Music. John Wiley & Sons Ltd., Chichester, United Kingdom. ISBN: 978-0-470-68339-2
- Kolb, B., Muhammad, A., Gibb, R., 2010. Searching for factors underlying cerebral plasticity in the normal and injured brain, Journal of Communication Disorders. University of Lethbridge, Canada. doi:10.1016/j.jcomdis.2011.04.007
- Loui P., 2015. A dual-stream neuroanatomy of singing. Wesleyan University, Universitiy of California Press, United States. doi:10.1525/MP.2015.32.3.232
- Luo N., Sui J., Abro A., Turner J.A., Damara E., Fu Z., Fan L., Chen J., Lin D., Zhuo C., Xu Y., Glahn D.C., Rodrigue A.L., Banich M.T., Pearlson G.D., Calhoun V.C., 2019. Structural brain architectures match intrinsic functional networks and vary across domains: A study from 15000+ individuals. China, United States. doi:10.1101/2019.12.17.879502
- Martínez-Molina N., Mas-Herrero E., Rodríguez-Fornells A., Robert J. Zatorre R.J., Marco-Pallerés J., 2019. White matter microstructure reflects individual differences in music reward sensitivity. Universitiy of Barcelona, Spain; McGill University, Canada. doi:10.1523/JNEUROSCI.2020-18.2019
- Oikkonen J., Huang Y., Onkamo P., Ukkola-Vuoti L., Raijas P., Karma K., Vieland V.J., Järvelä I., 2015. A genome-wide linkage and association study of musical aptitude identifies loci containing genes related to inner ear development and neurocognitive functions. Univerity of Helsinki, Finland. doi:10.1038/mp.2014.8
- Oxenham A.J., 2018. How we hear: The perception and neural coding of sound. University of Minnesota, United States. doi:10.1146/annurev-psych-122216-011635
- Patel A.D., 2007. Music, language and the brain. Oxford University Press NewYork, United States. doi:10.1093/acprof:oso/9780195123753.001.0001
- Poeppel D., 2003.The analysis of speech in different temporal integration windows: Cerebral lateralization as ‘asymmetric sampling in time’. New York University, United States. doi:10.1016/S0167-6393(02)00107-3
- Segado M., Hollinger A., Thibodeau J., Penhune V., Zatorre R.J., 2018 Partially Overlapping Brain Networks for Singing and Cello Playing. Concordia University Montreal, Canada. doi:10.3389/fnins.2018.00351
- Simonyan K., Barry Horwitz B., 2011. Laryngeal Motor Cortex and Control of Speech in Humans. Mount Sinai School of Medicine New York, United States. Neuroscientist 2011. April; 17(2): 197–208. doi:10.1177/1073858410386727
- Steel C.J., Zatorre R.J., 2018. Practice makes plasticity. Max Planck Institute, Leipzig Germany; McGill University, Montreal, Canada. doi:10.1038/s41593-018-0280-4
- Takahashi T., Suzuki M., Kurachi M., 2010. A follow-up MRI study of the superior temporal subregions in schizotypal disorder and first-episode schizophrenia. Schizophrenia Research. Volume 119, Issues 1–3, June 2010, Pages 65-74. Corpus ID: 26117184. doi:10.1016/j.schres.2009.12.006
- Tan Y.T., McPherson G.E., Peretz I., Berkovic S.F., Wilson S.J., 2014. The genetic basis of music ability. University of Melburne, Australia. doi:10.3389/fpsyg.2014.00658
- Toga A.W., Thompson P.M., 2003. Mapping brain asymmetry. UCLA School of Medicine, Los Angeles, United States. doi:10.1038/nrn1009
- Wang W., Wie L., Chen N., Jones J.A., Gong G., Liu H., 2019 Decreased Gray-Matter Volume in Insular Cortex as a Correlate of Singers’ Enhanced Sensorimotor Control of Vocal Production. University Guangzhou; Beijing Normal University, China; Wilfrid Laurier University, Canada. doi:10.3389/fnins.2019.00815
- Zamorano A.M., Zatorre R.J., Vuust P., Friberg A., Birbaumer N., Kleber B., 2019. Enhanced insular connectivity with speech sensorimotor regions in trained singers – a resting-state fMRI study. Germany, Switzerland, Denmark, Spain, Canada, Sweden. doi:10.1101/793083
- Zhang Y., Chen G., Wen H., Lu K., Liu Z., 2017. Musical Imagery Involves Wernicke’s Area in Bilateral and Anti-Correlated Network Interactions in Musicians. Purdue University, West Lafayette, United States. doi:10.1038/s41598-017-17178-4
Posee más de 25 años de experiencia como directora y profesora de canto para personas de todas las edades; es fundadora de un coro no corporativo y una escuela de canto, posee una amplia experiencia para inspirar a las personas a tener una mente abierta hacia nuevas formas de interpretar y percibir la música; es organizadora de encuentros corales internacionales para explorar culturas extranjeras y el mundo coral; siente una fascinación extrema por las artes en general y, especialmente, la ciencia.
- Ha participado en clases magistrales sobre dirección global.
- Conferencia Internacional sobre Música Comunitaria – Exposición: Desarrollo de un coro infantil de concierto basado en música comunitaria, ¿contradicción o confirmación?.
- Asistió a cada Simposio Mundial de Música Coral desde 1999.
- Ha participado en concursos corales internacionales y ha sido galardonada en varias ocasiones.
- Diploma en entrenamiento y docencia, Fulda – Alemania.
- Diploma en Dirección Coral para Coros Infantiles y Dirección Coral en Wolfenbüttel – Alemania.
- Información de contacto: ertl@icloud.com
Traducido del inglés al español por Diana Ho, Venezuela